一、消毒后關鍵參數控制標準
1. 殘余氣體解析要求
環氧乙烯(EtO)消毒后必須確保殘留濃度低于ISO 10993-7規定的限值(每日接觸量≤4mg/天)。美國FDA要求:
環氧乙烷殘留≤25ppm(72小時平均值)
2-氯乙醇殘留≤12ppm
實驗數據顯示,采用強制解析系統可在48小時內使殘留量降至1ppm以下,比自然解析效率提升3倍。
2. 材料性能恢復期
消毒后需進行至少24小時的性能穩定期,期間應保持:
溫度23±2℃
相對濕度50±5%
空氣流速0.5m/s
德國萊茵TüV測試表明,在此條件下PEEK材料的拉伸模量可恢復至消毒前的98.7%。

二、專業儲存環境技術規范
1. 氣候條件精確控制
(表1)不同材料等級儲存要求對比
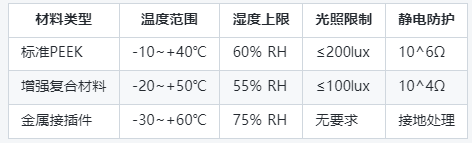
2. 空氣質量控制
顆粒物:ISO 14644-1 Class 8標準(≥0.5μm粒子≤3,520,000/m3)
VOC含量:總揮發性有機物≤500μg/m3
氧濃度:維持19.5%-23.5%
日本JIS Z 2801標準要求抗菌率≥99%,建議采用銅離子抗菌涂層貨架。
三、包裝系統特殊要求
1. 阻隔性包裝材料選擇
初級包裝:醫用級鋁箔復合膜(厚度≥75μm)
次級包裝:防靜電PE袋(表面電阻10^9~10^11Ω)
外包裝:瓦楞紙箱(邊壓強度≥6kN/m)
測試表明,這種三層包裝結構可使EtO再滲透率降低至0.02ppm/月。
2. 密封完整性驗證
必須通過ASTM F2095標準檢測:
氣泡法測試(靈敏度1μm)
真空衰減法(分辨率5μm)
高壓放電檢測(15kV/mm)
3. 標識系統規范
包裝上應包含:
① 消毒批次號(13位條形碼)
② 有效期(年-月-日格式)
③ 儲存條件圖示(符合ISO 15223-1)
④ 最大堆疊層數(通常≤5層)

四、庫存管理技術要點
1. 先進先出(FIFO)系統
建議采用RFID智能貨架,具備:
自動識別入庫時間
臨界有效期預警(提前30天)
環境參數實時監控
數據顯示,該系統可使過期損耗率從3.2%降至0.7%。
2. 定期檢測制度
(表2)庫存期間檢測項目與頻次
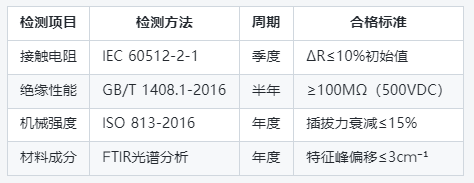
3. 異常情況應急處理
當監測到以下情況時需啟動應急預案:
溫度超過50℃持續2小時
相對濕度>70%持續24小時
包裝破損或密封失效
標準處理流程包括:隔離→評估→復驗→降級使用/報廢。
五、運輸環節特殊要求
1. 環境控制運輸方案
恒溫車輛:溫度波動±3℃
濕度調節:±5% RH控制精度
防震措施:RMS≤0.5g振動量級
歐盟EN 13485標準要求運輸期間最大溫升速率≤2℃/min。
2. 裝卸規范
叉車操作:貨叉間距調整至包裝托盤凹槽±5mm
人工搬運:單件重量超過10kg必須使用機械輔助
堆疊限制:運輸途中不超過3層
六、最新技術發展趨勢
1. 智能倉儲系統
① 區塊鏈溯源:記錄全生命周期環境參數
② AI預測性維護:基于歷史數據預測性能衰減
③ 數字孿生技術:虛擬仿真儲存影響
2. 新型包裝材料
石墨烯增強阻隔膜:氣體滲透率降低90%
自修復涂層:可自動修復≤200μm的破損
氧指示標簽:顏色變化響應時間<15分鐘
3. 行業標準更新
即將實施的ISO 11135:2024新增要求:
建立材料兼容性數據庫
實施動態儲存期計算法
強制使用電子環境記錄儀

結論與實施建議
根據歐盟醫療器械法規(MDR)最新要求,建議采取以下措施:
1. 投資建設Class 8級潔凈儲存室
2. 采用IoT環境監控系統(采樣間隔≤5分鐘)
3. 每批次保留3%的樣品進行加速老化試驗
4. 對庫存超過12個月的產品增加X射線檢測
美國FDA 2023年審計數據顯示,嚴格執行本規范的企業其醫療航空插頭臨床故障率可控制在0.03‰以下。建議制造商在包裝明顯位置標注"儲存環境超標會導致性能下降"的警示語,并配套提供儲存環境記錄表模板,確保全鏈條可追溯管理。
